Единицы измерения параметров газа
Измерение давления газа
Основным показателем, характеризующим сеть газопотрсбления, является давление газа в газопроводе. Обеспечение нормативного давления газа перед газоиспользующим оборудованием позволяет обеспечить качественное сжигание топлива и устойчивую работу горелок.
Давление — отношение силы к площади, на которую она действует, а для газа сила, с которой он действует на единицу площади поверхности сосуда. Давление, отсчитываемое от абсолютного нуля, называется абсолютным, давление, оказываемое атмосферой атмосферным. Избыточное давление больше атмосферного, оно отсчитывается от уже имеющегося атмосферного давления:
Р изб = Р абс -Р атм ,
где Р изб — избыточное давление;
P абс — абсолютное давление;
Р атм — атмосферное давление.
При измерении разрежения определяют, насколько давление в каком-либо ограниченном объеме меньше атмосферного. Это давление называют вакуумметрическим:
Р вак = Р атм — Р абс ,
где Р вак — вакуумметрическое давление.
При обслуживании и ремонте внутридомового газового оборудования контролируется избыточное давление газа или воды, а также вакуумметрическое давление при измерении разрежения в системах удаления дыма.
В системе СИ основной единицей измерения давления является Паскаль (Па). Один паскаль — это давление, оказываемое силой в 1 ньютон (Н) на площадь в 1 квадратный метр (м²).
Для измерения давления газа в газопроводах жилых домов как единицу измерения зачастую используют миллиметр водяного столба (мм.вод. ст.). Эта единица наглядна и понятна, особенно при использовании жидкостного манометра.
В Западной Европе для измерения давления применяется бар (bar). Один бар равен 100.000 Па, что приблизительно равно 1 кгс/см². Один миллибар (mbar) составляет 100 Па, он приблизительно равен 10 мм.в.ст (1 mbar — 10 мм.в.ст.). Основной единицей, используемой в настоящей книге при описании газоиспользующего оборудования, является бар. Для характеристик состояния газового топлива применяется единица измерения Паскаль (даПа).
Паскаль очень мал, па практике применяют кратные ему единицы:
1 декапаскаль (1 даПа) = 10 Па — 1 мм.в.ст;
1 гектопаскаль (1 гПа) = 100 Па -1 mbar;
1 килопаскаль (1 кПа) = 1000 Па -100 мм.в.ст.;
1 Мегапаскаль (1 МПа)= 1000000 Па — 10 кгс/см² или 1 кгс/см² — 0,1 МПа.
Необходимо заметить, что точное значение 1 мм.в.ст = 9,81 Па, а 1 кгс/см² = 9,81 х 104 Па, но для практических целей достаточно запомнить, что 1 мм.в.ст -10 Па (1 даПа), а 1 кгс/см² — 0,1 МПа.
При измерении избыточного давления или разрежения происходит определение его величины с помощью специальных приборов манометров, напоромеров, тягонапоромеров. Точность измерения характеризуется погрешностью — отклонением результата измерения от истинного значения измеряемой величины. Класс точности прибора характеризуется пределом допускаемой погрешности — наибольшей погрешностью прибора, при которой он может быть признан годным и допущен к применению. У показывающих пружинных манометров бывают следующие классы точности: 0,4; 0,6; 1; 1,5; 2,5; 4. У манометра с классом точности 1.5 результат измерения может отличаться от истинного значения не более чем на 1,5%.
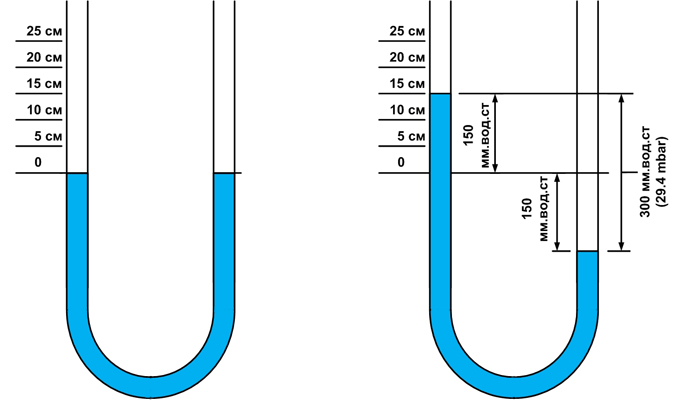
Жидкостные U-образные манометры применяются для измерения небольших величин давления, чаще всего низкого (до 500 даПа). Их применяют для измерения давления газа, а также давления воздуха, идущего на горение в горелках с принудительной подачей воздуха. Жидкостной манометр — это стеклянная или прозрачная пластиковая U-образная трубка, которая прикреплена к деревянной или пластмассовой панели. На панели имеется шкала с делениями в миллиметрах, от нуля вверх и от нуля вниз. У современных манометров шкала может иметь деления в паскалях (Па).
Для определения давления необходимо сложить высоту столба жидкости от нуля вверх — 60 мм.вод.ст. и от нуля вниз — 60 мм.вод.ст. Сумма двух значений — 120 мм.вод.ст. — даст величину измеренного давления. В настоящее время несмотря на простоту конструкции жидкостные манометры находят ограниченное применение из-за больших габаритов.
Пружинные манометры применяются в настенных котлах для измерения избыточного давления воды в системах отопления и горячего водоснабжения. В отдельных котлах применяются термоманометры, которые одновременно измеряют давление и температуру воды у настенных котлов.
Для наладочных и ремонтных работах на газопроводах и газоиспользующем оборудовании применяют цифровые манометры, которые позволяют вести измерение давления газа с выводом его величины на жидкокристаллический дисплей. Цифровые манометры TESTO 312 производства немецкой фирмы Testo AG предназначены для настройки и обслуживания сетей газопотребления. Принцип действия TESTO 312 основан на преобразовании поступающего на его вход давления в электрический сигнал, пропорциональный измеряемому давлению. Электропитание приборов осуществляется от аккумуляторной батареи напряжением 9 В. Манометры TESTO 312-2 могут измерять давление в диапазонах ± 40 гПа (± 40 mbar) и ± 200 гПа (± 200 mbar), манометры TESTO 312-3 в диапазонах ± 300 гПа (± 300 mbar) и ± 6000 гПа (± 6000 mbar). Цифровые манометры TESTO 312-2 также могут измерять разрежение в диапазоне ± 40 гПа (± 40 mbar). На дисплее отражается время, измеряемый параметр, измеренная величина с указанием единицы измерения. При превышении максимального давления на входе прибора он подает световую и звуковую индикацию перегрузки.
ПАРАМЕТРЫ СОСТОЯНИЯ. ЗАКОНЫ ИДЕАЛЬНОГО ГАЗА
Важным термодинамическим состоянием системы является состояние равновесия. Это состояние обладает свойством не изменяться до тех пор, пока внешние условия остаются неизменными. Например, газ, заключенный в сосуд постоянного объема, находится в равновесии, когда его давление и температура повсюду постоянны, температура равна температуре окружающей среды, а внешние силы уравновешены силами внутреннего давления. Различные состояния равновесия отличаются числовыми значениями физических величин, называемых параметрами состояния, или термодинамическими параметрами.
Каждому состоянию соответствуют определенные значения абсолютного давления, температуры и удельного объема, не зависящие от количества вещества и поэтому называемые интенсивными параметрами. Зависящие от количества вещества свойства, такие как объем, называют экстенсивными.
Абсолютное давление р — сила, действующая на единицу площади по нормали к поверхности оболочки, в которой находится газ. Давление газа распределено равномерно по поверхности оболочки. Единица измерения давления в системе СИ 1 Н/м 2 называется паскаль (Па). Для больших давлений используется единица измерения давления 1 бар = 10 5 Па, или 1 МПа = 10 6 Па. В технике также используются следующие единицы измерения давления:
- • 1 кгс /см 2 = 1 атм (техническая атмосфера);
- • 1 мм рт. ст. (миллиметр ртутного столба);
- • 1 мм вод. ст. (миллиметр водяного столба).
Соотношения между единицами измерения давления:
1 бар = 10 5 Па = 0,1 МПа = 1,02 кгс/см 2 = 750 мм рт. ст. =
= 1,02 • 10 4 мм вод. ст.
Давление газов выше атмосферного измеряется манометрами, ниже атмосферного — вакуумметрами. Эти приборы показывают разность между абсолютным давлением и атмосферным (барометрическим). Таким образом, манометры показывают избыточное (манометрическое) давление рм =р — В, а вакуумметры — разряжение (вакуум) рраз = В-p, гдер — абсолютное давление, В — барометрическое давление.
Удельный объем v — объем единицы массы вещества. В системе СИ единица измерения удельного объема — м 3 /кх, эта же единица в основном используется в технике.
Величина, обратная удельному объему, — плотность, р = 1/v, кг/м 3 .
Температура — некоторая статистическая величина, пропорциональная средней кинетической энергии движения молекул и атомов, называемого тепловым. Характеризует уровень нагретости тела. Для измерения температуры применяются различные приборы (термометры), принцип действия которых основан на законах изменения определенных свойств вещества при изменении температуры, например объема, электрического сопротивления и т.д. Для количественной характеристики температуры используются различные температурные шкалы. В науке и технике в основном применяются две шкалы: шкала Цельсия, точнее — близкая к ней международная стоградусная шкала, и термодинамическая шкала температуры — шкала Кельвина. При построении шкалы Цельсия за ноль градусов принято состояние точки плавления льда, за сто градусов — состояние точки кипения воды при нормальном атмосферном давлении (760 мм рт. ст. =0,1013 МПа). Единица измерения температуры по шкале Цельсия — 1 °С (один градус Цельсия). Единица измерения температуры по термодинамической шкале — 1 К (один Кельвин). При определении величины 1 К используется то же правило, что и при определении величины 1 °С, т.е. разность между значениями температуры в точках кипения воды и плавления льда делится на сто, поэтому 1 К = 1 °С.
По шкале Кельвина ноль соответствует предельному состоянию, при котором отсутствует тепловое движение молекул и атомов и давление равно нулю. Точка плавления льда при нормальном атмосферном давлении соответствует температуре по шкале Кельвина 273,15 К. Значение температуры по шкале Кельвина называют абсолютной температурой и обозначают Т. Соотношение между температурой по шкале Цельсия t и абсолютной температурой имеет вид
Параметры состояния не могут устанавливаться произвольным образом, между ними существует зависимость, называемая уравнением состояния:
Из уравнения (1.1) следует, например, что для однородного газа произвольно заданным двум параметрам состояния соответствует единственное значение третьего параметра. Вид функции (1.1) зависит от состава и состояния вещества в системе.
В технической термодинамике для упрощения получения основных термодинамических соотношений в качестве рабочего тела принят идеальный газ. Молекулы такого газа представляют собой материальные точки с пренебрежимо малыми размерами; взаимодействие молекул ограничено упругими соударениями; силы взаимного притяжения и отталкивания исчезающе малы. Для идеального газа получены важные закономерности. Еще в XVII в. Робертом Бойлем и Эдмом Мариоттом установлено, что при постоянной температуре произведение давления газа на его объем остается постоянным:
Уравнение (1.2) получило название закона Бойля — Мариотта.
В 1802 г. Жозеф Луи Гей-Люссак установил зависимость между температурой и объемом газа при постоянном давлении:
которая получила название закона Гей-Люссака.
Соотношения (1.2) и (1.3) получены из опытов с реальными газами при условиях, близких к атмосферным. Впоследствии более точными измерениями было установлено, что эти зависимости не выполняются абсолютно строго.
В 1811 г. Амедео Авогадро выдвинул положение, что в равных объемах любых идеальных газов при одинаковых температурах и одинаковых давлениях заключено равное число молекул. Это положение называется законом Авогадро. Из закона Авогадро следует, что при одинаковых давлениях и температурах объемы молей всех идеальных газов равны. Так, объем одного моля идеального газа при нормальных физических условиях (р = 760 мм рт. ст. = 1,013 • 10 5 Па; t= 0 °С) равен 22,4 м 3 /кмоль.
В 1834 г. Бенуа Поль Эмиль Клапейрон получил уравнение состояния идеального газа в виде
где коэффициент пропорциональности В зависит от рода газа и его массы.
В 1874 г. Д.И. Менделеев, используя закон Авогадро, вывел уравнение состояния для одного моля идеального газа:
где Vц — объем одного моля; R — универсальная газовая постоянная.
Подстановкой в уравнение (1.5) значений параметров газа при нормальных физических условиях в системе СИ (Т = 273,15 К;
= 22,4 м 3 /кмоль; р = 1,013 • 10 5 Па) определяется величина R = 8314 ДжДкмоль К). Соотношение (1.5) носит название уравнение Клапейрона — Менделеева. Оно обобщает законы Бойля — Мариотта, Гей-Люссака и Авогадро. Используются также и другие формы записи уравнения (1.5). Так, разделив выражение (1.5) на молекулярную массу р, имея в виду, что Г^/р = г, получаем для 1 кг газа
или
где R = 8314/р, Дж/(кг-К) — газовая постоянная, зависящая только от молекулярной массы газа.
Для некоторого количества газа массой G из уравнения (1.6) следует:
для одного моля газа ю
Уравнения состояния реальных газов рассмотрены в гл. 5.
Переход системы из одного состояния равновесия в другое в результате теплового и механического взаимодействия с окружающей средой называют термодинамическим процессом. Если рабочее тело, переходя из одного равновесного состояния в другое, последовательно проходит промежуточные равновесные состояния, то такой процесс называется равновесным. Равновесный процесс можно осуществить, если изменять внешние условия так медленно, чтобы система успевала постепенно приходить в равновесное состояние в соответствии с изменившимися условиями. Таким образом, равновесный процесс протекает в результате элементарно малых нарушений равновесия, а время его протекания стремится к бесконечности. Многие реальные процессы близки к равновесным. Их называют квазиравновесными.
Процессы могут происходить при постоянстве одного из параметров состояния. Процесс при р = const называется изобарным; при v = const — изохорным при Т = const — изотермическим.
Так как для газа состояние равновесия полностью определяется двумя независимыми параметрами, то для наглядности анализа можно использовать графическое изображение процессов в координатах (р, v), (р, Г) и (Г, у). Наибольшее применение имеет система координату, у. Например, переход из состояния 1 (рх; Vj) в состояние 2 (р2— у2) представляется на графике (рис. 1.1) кривой, являющейся геометрическим местом точек, соответствующих промежуточным состояниям, через которые последовательно проходит рабочее тело при переходе из состояния 1 в состояние 2.

Рис. 1.1. Термодинамический процесс
Единица измерения расхода газа
5 сообщений в этой теме
Рекомендуемые сообщения
Создайте аккаунт или авторизуйтесь, чтобы оставить комментарий
Комментарии могут оставлять только зарегистрированные пользователи
Создать аккаунт
Зарегистрировать новый аккаунт.
Войти
Есть аккаунт? Войти.
Недавно просматривали 0 пользователей
Ни один зарегистрированный пользователь не просматривает эту страницу.
Популярные темы
Автор: DANTE
Создана 6 часов назад
Автор: Максимум
Создана 8 часов назад
Автор: natalen555
Создана 20 Ноября
Автор: berkut008
Создана 16 Января
Автор: sav
Создана 13 Января 2012
Автор: efim
Создана 4 Марта
Автор: gremp
Создана 31 Октября
Автор: sav
Создана 13 Января 2012
Автор: E_lena
Создана 1 Апреля 2016
Автор: efim
Создана 4 Марта
Автор: AtaVist
Создана 11 Августа 2017
Автор: mpanikovskiy
Создана 14 Июня 2012
Автор: метролог2009
Создана 10 Сентября 2015
Автор: sergeevich-33
Создана 26 Декабря 2022
Автор: efim
Создана 31 Декабря 2015
Автор: AtaVist
Создана 11 Августа 2017
Автор: Metrolog-sever
Создана 2 Июля 2014
Автор: UNECE
Создана 8 Декабря 2016
Автор: E_lena
Создана 1 Апреля 2016
Автор: метролог2009
Создана 10 Сентября 2015









